界面新闻记者 |
界面新闻编辑 | 谢欣
过去几年全球最火创新药PD-1抑制剂突发利空。
当地时间9月26日,美国食药监局(FDA)肿瘤药物咨询委员会(ODAC)的两场投票结果显示,与会专家分别以10:2、11:1的投票结果,反对在HER2阴性、PD-L1表达低于1%的胃(G)/胃食管交界处(GEJ)腺癌患者中、在PD-L1表达低于1%的食管鳞癌(ESCC)患者中使用PD-1抑制剂。
该ODAC会议涉及三款PD-1产品,分别为默沙东的帕博利珠单抗(俗称“K药”)、BMS的纳武利尤单抗(俗称“O药”),以及百济神州的替雷利珠单抗。
其中,K药、O药已在美获批,用于一线治疗HER阴性胃癌和食管鳞癌。此前,两者获批的适用人群均为全人群,与患者的PD-L1表达量无关。此外,百济的替雷利珠单抗也在胃癌和食管鳞癌的一线治疗上,向FDA提交了相同的上市申请,正处于评审中。
尽管ODAC会议结果对FDA不具约束性,不过,前述投票还是意味着K药、O药已经获批的胃癌、食管鳞癌适应证或将修改、受限,而替雷利珠单抗的上市批准也或将受到影响。
截至美东时间9月26日收盘,默沙东、BMS、百济神州股价分别为113.090美元/股、50.120美元/股、212.530美元/股,分别变动-1.43%、0.34%、2.81%。9月27日,百济神州A股股价午后高涨,截至发稿报159.91元/股,上涨4.96%,当下市值2205亿元。
实际上,随着靶向治疗、免疫治疗发展,肿瘤药物开发进入“精准时代”。经典案例如阿斯利康的吉非替尼在美加速获批后,3期临床结果不及预期,只得退市收场。但随后,研究者发现该药疗效与EGFR基因突变有关。最终,吉非替尼获批用于EGFR突变的非小细胞肺癌,并成为最早的靶向肿瘤药。
可以说,在一定程度上,药物开发的工作就是试图将风险收益比更佳的分子提供给更可能产生临床获益的患者群体,由此在成功获批和更大商业收益之间达到平衡。其中,筛出更适合患者的筛子即为“生物标志物”,这在吉非替尼上是“EGFR基因”,在本次ODAC会议中则是“PD-L1表达水平”。
以胃癌为例,据该会议公开简报,O药、K药、替雷利珠单抗分别提交的关键研究CHECKMATE-649、KEYNOTE-859、RATIONALE-305表明,在HER2阴性胃癌一线治疗中,PD-1在ITT人群(意向治疗人群,即所有入组患者)中的OS(总生存期)获益似乎主要归因于PD-L1表达较高的亚组患者,而在PD-L1低表达或无表达患者中OS获益有限。
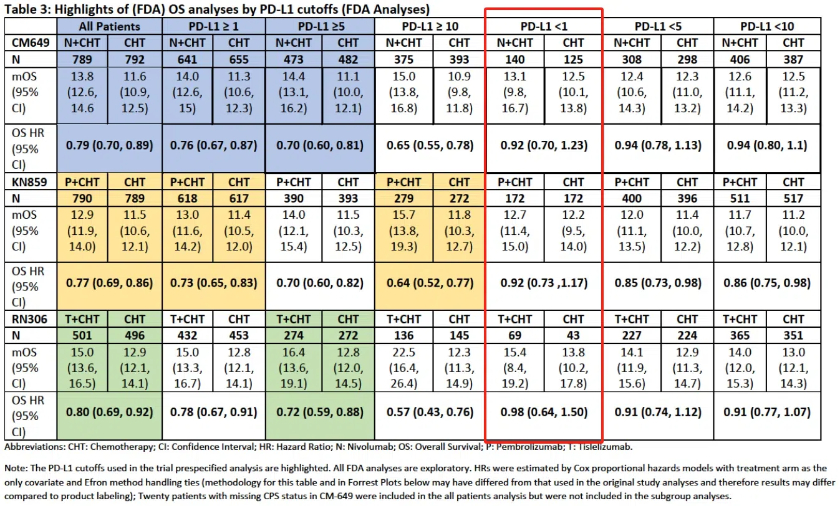
据简报材料,过往数据也表明,在该治疗上,PD-L1≥10%的患者获益最大;PD-L1<10%的患者获益尚不清楚;PD-L1<1%的患者似乎不会获益,但给予PD-1治疗可能会给他们造成严重免疫相关不良反应等伤害。
由此,会议讨论的目的包括,在PD-1一线治疗胃癌中,PD-L1表达水平作为预测性生物标志物的充分性,是否该以此选择患者、修改O药、K药的适应证范围。
另外,若其成为分层依据,新的问题是这口筛子该如何编织。因为各家药企测量PD-L1的指标、检测试剂各不相同。“各改各的”会导致同类PD-1药物的PD-L1阈值不同,阻碍同一适应证治疗的一致性,以及未来改善患者预后的研究。
从投票结果看,本次选择的PD-L1阈值为CPS(综合阳性评分)<1%,该结果推荐适用于本次涉及的所有PD-1产品。食管鳞癌方面的讨论和投票也是类似。简单来说,FDA的专家们大多不太认可上述几款PD-1在这一人群中的治疗获益,希望对其使用做出限制。
对各家药企而言,生物标志物及其指标的选择无疑会影响到药物试验设计、成功率和此后的商业价值。
9月27日,百济神州方面表示,ODAC成员通过投票推荐适用于同类所有药物的PD-L1表达水平界定值,用于PD-1抑制剂治疗胃癌和食管鳞癌患者,将有利于临床医生及其患者建立一个标准。公司期待与FDA紧密合作完成替雷利珠单抗的审评工作。
对于国内创新药公司而言,出海寻求更大市场已成为共识。此前,替雷利珠单抗已在美获批二线治疗食管鳞癌。此外,百济神州另一核心产品BTK抑制剂泽布替尼也已在中美多地获批上市,其2023年销售额超10亿美元,成为首个达到该成就的国产新药分子。